2023四川省成都市高三化学第二次诊断性考试试题
2023四川省成都市高三化学诊断性考试试题
本试卷分选择题和非选择题两部分。第I卷(选择题)1至5页,第II卷(非选择题)6至14页,共14页;满分300分,考试时间150分钟。
注意事项:
1.答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡
皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,只将答题卡交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 A1-27 S-32
第I卷(选择题)
一、选择题:本题共7个小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列与生活中吃、穿、用、行相关的说法中错误的是
A.铁粉可作为富脂食品包装中的抗氧化剂 B.羽绒、丝绸是属于糖类的高分子材料
C.不粘锅涂层聚四氟乙烯的化学性质稳定 D.地铁列车的不锈钢车体材质属于合金材料
8.设阿伏加德罗常数的值为NA,下列说法一定正确的是
A.12g硫酸氢钠固体中含有的离子总数为0.2NA
B.标准状况下,2.24LCO2气体与足量过氧化钠固体充分反应,转移电子数为0.2NA
C.1 molC3H6完全燃烧,有2NA个C-C键断裂
D.25℃,1 mol·L-1NaHCO3溶液中含有HCO3-数目小于NA
9.环己醇(![]() )的传统合成(方法1)和改良合成(方法2)方法如下:
)的传统合成(方法1)和改良合成(方法2)方法如下:

下列有关说法错误的是
A.方法2的反应类型均为加成反应B.环己醇六元环上的一氯代物有3种
C.方法2较方法1的原子经济性更高D.乙醇与环己醇并不互为同系物
10.四种不同主族的短周期元素X、Y、Z、W,其原子序数依次增大。仅X、Y、Z同周期,且X、Y、Z简单气态氢化物电子总数相同,0.10mol·L-1W最高价氧化物水化物溶液pH=1.00.
下列有关说法正确的是
A.X、Y、Z的原子半径依次增大B.含W的钠盐水溶液一定是中性溶液
 C.W2与SO2混合后消毒效果更强D.Y、W简单氢化物相遇会产生白烟
C.W2与SO2混合后消毒效果更强D.Y、W简单氢化物相遇会产生白烟
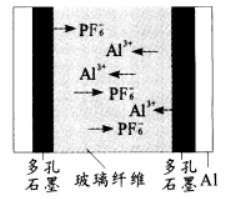
11.我国科学家成功研制出一种双离子电池(DIBs),这种电池采用廉价易得的石墨为正极材料(C6PF6),铝作为负极材料。放电时,阴、阳离子分别从正负极脱出至电解液中,示意图见右图。下列关于该电池的说法错误的是
A.开始放电时,玻璃纤维中的离子数目增多
B.放电时,正极的电极反应为C6PF6+e-=6C+PF6-
C.充电时,若转移1mol e-阴极电极将增重27g
D.充电时,Al3+通过右侧多孔石墨到Al电极放电
12.下列对相关实验的解释或结论正确的是

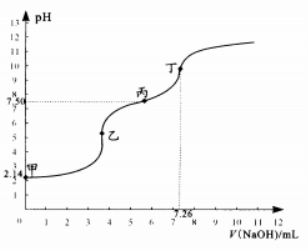 13.向25.00 mL某浓度新制氯水中滴入0.0556 mol/L
13.向25.00 mL某浓度新制氯水中滴入0.0556 mol/L
NaOH溶液的滴定曲线如右图。已知10-2.14≈7.0x10-3.
下列说法错误的是
A.甲到乙点发生的主要非氧化还原反应的离子方程式为:H++OH-=H2O
B.甲到乙过程中使用甲基橙作指示剂
C.已知次氯酸的电离常数Ka=10-7.50,则丙点溶液中
c(Na+)>c(Cl-)>c(HClO)=c(ClO-)
D.氯水中存在平衡:Cl2+H2O-H++Cl-+HCIO,该平衡常数K的数量级为10-4
26.(14分)
氯磺酸(HSO3Cl)沸点约152℃,易溶于硫酸,可迅速吸潮产生浓烈的白雾。常温下制取氯磺酸的基本原理为HCl(g)+SO3=HSO3Cl(1),其中SO3由发烟硫酸提供。可用下列仪器装置进行制备(图中夹持、固定仪器等已略去)。
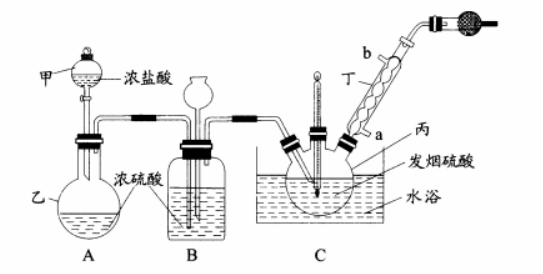
回答下列问题:
(1)仪器丙的名称是 ;实验过程中仪器丁的进水口为 (填“a”或“b”)口。
(2)球形干燥器中装有 (填写试剂名称);若无此装置,氯磺酸发生水解的化学方程式为
.
(3)装置B具有干燥气体、 等作用。
(4)当C装置中出现 现象时可判断已大量制得氯磺酸并停止通入HCl气体;随即将装置C改为油浴蒸馏装置,分离氯磺酸时依然要通人HCl气体的目的是 。
(5)氯磺酸产品中可能含有少量Fe2+和Fe3+,现测定其中总铁量。已知在pH为3~9时,邻菲啰啉能与Fe2+形成橙色配合物Fe-phen.Fe-phen在510nm处的吸光度A与溶液中Fe2+浓度呈线性关系,如下所示:

①测定实验步骤:取一定质量氯磺酸产品,加水水解为一定体积的强酸性溶液,加入NH2OH
将Fe3+还原为Fe2+;然后依次 (填写选项)。
A.加入0.5%邻菲啰啉溶液B.加入缓冲溶液调节pH=5.0C.摇匀、静置
②在一定条件下测定溶液的平均吸光度A=0.25,该产品中总铁量为 mol·L-1(保留两位有效数字)。
27.(15分)
丙酮蒸气热裂解可生产乙烯酮,反应为![]()
现对该热裂解反应进行研究,回答下列问题:
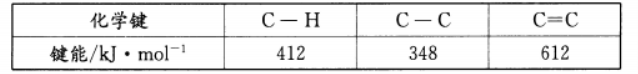
(1)①根据表格中的键能数据,计算ΔH=_ kJ·mol-1;
②该反应在 (填“低温”或“高温”或“任意温度”)条件下可自发进行。
(2)在恒容绝热密闭容器中,充人丙酮蒸气,可以判断下列到达平衡状态的是 .
 A.O=C=CH2(g)消耗速率与CH4生成速率相等
A.O=C=CH2(g)消耗速率与CH4生成速率相等
B.容器内密度不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
E.O=C=CH2(g)和CH4(g)的浓度比保持不变
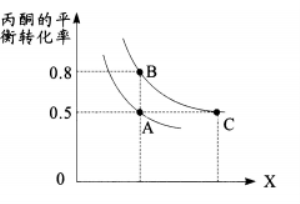
(3)丙酮的平衡转化率随温度、压强变化如图所示:
①图中X表示的物理量是 ;温度:A点 B点(填“>”、“<”或“=”),说明判断理由 ;
②A、C两点化学平衡常数KA Kc(填“>”、 “<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是 。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa).
①经过时间tmin,丙酮分解10%.用单位时间内气体分压变化表示的反应速率v(丙酮)
kPa/min;
②该条件平衡时丙酮分解率为a,则Kp=_ (以分压表示,分压=总压x物质的量分数)。
28.(14分)
用主要含盐酸及少量Fe2+、Cu2+、H3AsO3等杂质的废酸和锌渣(主要含ZnO及少量PbCO3杂
质)为原料制备ZnCl2溶液的工艺流程如下:

已知:25℃下有关物质的溶度积:
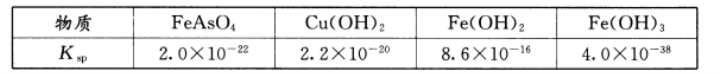
回答下列问题:
(1)H3AsO3中As的化合价为 ;通入大量空气将H3AsO3氧化为弱酸H3AsO4,同时产生了某种胶体,溶液pH降低。用一个离子方程式解释氧化产生胶体的过程 。
(2)“氧化”的目的是除净砷元素和大部分铁元素。若“氧化”中共可产生6.0x10-4 mol·L-1
AsO43-和8.5x10-4mol·L-1Fe3+,则FeAsO4沉淀后溶液中c(AsO43-)= _mol·L-1(忽略水解作用)。
(3)“过滤”时,溶液的 pH应适中。pH过低会导致FeAsO4沉淀发生 ,造成As去除率降低;pH过高会导致FeAsO4沉淀发生 ,也会造成As去除率降低。
(4)“滤渣B”中除含有一些PbCl2、Fe(OH)3外,还含有_ (填写化学式)。
(5)“净化”时,Zn还原微量的PbCl2.相应的化学方程式为 。
(6)ZnC2-Ka混合溶液常用于电镀锌领域,加入KCl的作用是 ,其阴极反应式是 。
35.[化学选修3:物质结构与性质](15分)
人体血红蛋白中含有Fe2+一卟啉环配合物,结合O2后,其基本结构如图(烃基略去)。回
答下列问题:
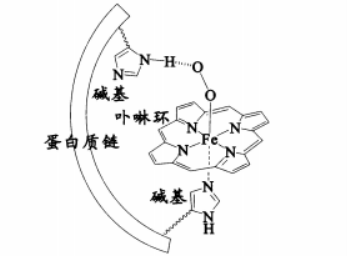
(1)Fe、N、C、H四种元素中电负性最大的是 (填写元素符号);血红蛋白结合O2前
后的中心Fe均为正二价,其基态时3d轨道中电子数为 。
(2)卟啉环中所有原子共平面,其中N的杂化方式为 ,C-Nσ键有 个。
(3)图中Fe2+的配位数为_;其中一个碱基通过 作用与O2分子结合,另一碱基的N原子提供 与Fe2+配位。
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更 (填“高”或“低”),说明理由 。
(5)从298K升温到1200K时,体心立方型的![]() -Fe变化为面心立方最密堆积,配位数 (填“变大”、“不变”或“变小”)。假定升温时Fe原子半径不变,体积变为低温时的 %(已知
-Fe变化为面心立方最密堆积,配位数 (填“变大”、“不变”或“变小”)。假定升温时Fe原子半径不变,体积变为低温时的 %(已知![]() =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。
36.[化学选修5:有机化学基础](15分)
利他林(Ritalin)H被用于治疗注意力缺陷多动障碍,被称为“聪明药”。利他林H的合成路线如下:
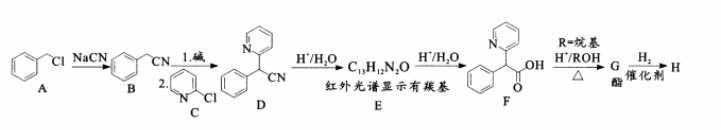
(1)A的分子式为 ;F的含氧官能团名称为 。
(2)A转变为B的反应类型为 ,B转化为D步骤中加入碱的作用是 。
(3)E的结构简式为 。
(4)F转化为酯G的化学反应方程式为 。
(5)若质谱法测得G和H的相对分子质量分别为227和233.H中除烷基R以外,仅有10种化学环境的氢原子,则ROH的化学名称为 ,利他林H的结构简式为 。





1




